Polyarthrite rhumatoïde et maladies parodontales
Introduction
La polyarthrite rhumatoïde est une maladie inflammatoire chronique auto-immune qui affecte principalement les membranes synoviales de plusieurs articulations, entraînant leur inflammation, leur prolifération et, finalement, leur destruction. Si elle n'est pas traitée, elle évolue vers la destruction du cartilage articulaire, entraînant des déformations et une incapacité fonctionnelle, avec un déclin marqué de la qualité de vie du patient. Même si la lésion principale se situe au niveau des membranes synoviales des articulations périphériques, chez au moins 40 % des patients atteints de polyarthrite rhumatoïde, cette maladie peut toucher d'autres organes, avec des manifestations extra-articulaires spécifiques ou non. (1)
Cette maladie se manifeste généralement chez des individus relativement jeunes (40-60 ans) et touche plus fréquemment les femmes, avec un rapport de 3 :1 par rapport aux hommes (2). Son taux d'incidence annuel est d'environ 36/100 000 pour les femmes et 16/100 000 pour les hommes en Europe. (3)
L'étiologie de la polyarthrite rhumatoïde (PR) est complexe, et ses mécanismes pathogéniques sous-jacents ne sont pas entièrement élucidés. Cependant, cette maladie présente des similitudes frappantes avec les maladies parodontales (MP) en ce qui concerne son contexte immunologique, biologique et génétique, ceci suggère l’existence d’un lien entre les deux.
Association épidémiologique entre la parodontite et la polyarthrite rhumatoïde
Les preuves de l'association entre la parodontite et la polyarthrite rhumatoïde proviennent d'études cas-témoins. La plupart de ces études montrent une association entre la parodontite et la polyarthrite rhumatoïde, avec des odds ratio allant de 1,82 à 20,57 et des patients atteints de polyarthrite rhumatoïde présentant une prévalence élevée de parodontite ainsi que des pertes dentaires. (4) Pablo et al. (5) ont étudié 103 patients âgés de plus de 60 ans souffrant de polyarthrite rhumatoïde. Les auteurs ont constaté que les patients atteints de polyarthrite rhumatoïde présentaient un risque accru de parodontite avec un odds ratio de 4,1 (intervalle de confiance à 95 % 1,3-13,1) après ajustement à l'âge, le sexe, la race et au tabagisme.
Mécanismes pathogéniques expliquant le lien d’association
De nombreuses études ont été développées au cours des 10 dernières années pour expliquer les mécanismes reliant la PR et la MP. Il a été démontré que Porphyromonas gingivalis joue un rôle important dans l'activation de la destruction parodontale, cette dernière initie un processus de destruction par les neutrophiles. Ces bactéries parodontopathogènes sont responsable de l’initiation d’une réponse immunitaire médiée par les neutrophiles, les monocytes et les lymphocytes T et B. (6)
Au cours de l'inflammation, la citrullination des peptides ou des protéines a lieu sous l'action de l'enzyme peptidyl arginine désaminase (PAD). Cette enzyme induit la citrullination de certaines protéines en antigènes, qui sont reconnus par des anticorps peptidiques anti-cycliques. Ces anticorps sont des marqueurs spécifiques de la polyarthrite rhumatoïde, étant trouvés chez 80% des patients et avec une spécificité de 99 %(6). Ils sont produits dans la membrane synoviale enflammée.
Certaines études montrent que les taux de ces anticorps sont significativement plus élevés chez les patients atteints de PR avec une MP sévère que chez les patients atteints de PR sans MP(6).
La PAD est une enzyme exprimée par les cellules inflammatoires mais aussi par Porphyromonas gingivalis. Cette dernière est la seule bactérie qui exprime l'enzyme PAD. Ceci est révélateur du concept selon lequel l'infection par ce micro-organisme pourrait induire ou accélérer la PR, facilitant la présence des antigènes et la production des anticorps.
D’autant plus que nombreuses études ont montré que les anticorps dirigés contre Porphyromonas gingivalis sont présents en plus forte concentration chez les patients atteints de PR (6). Un résumé des liens biologiques possibles entre la PR et la MP est présenté dans la fig 1 (7).
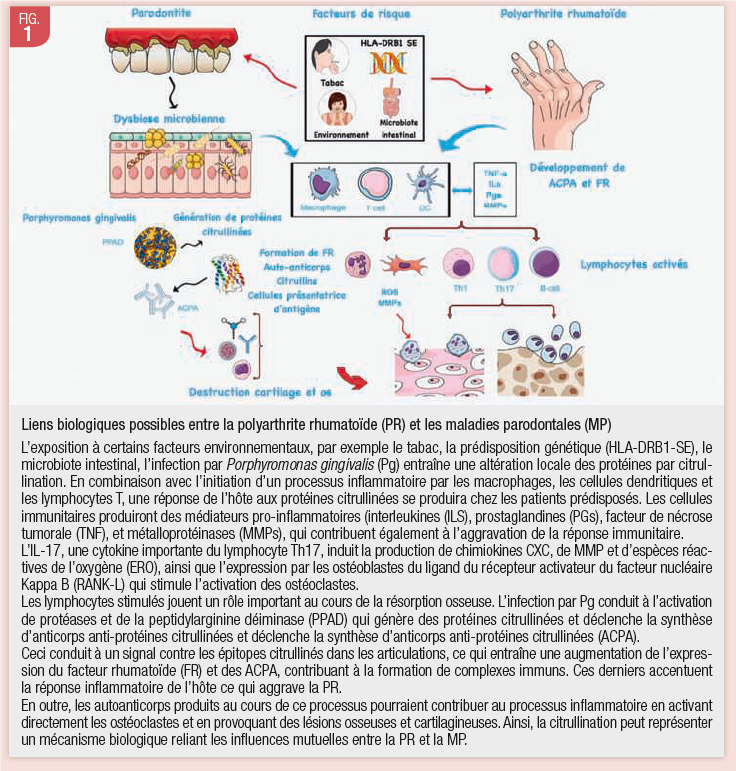


Facteurs de risque génétiques et environnementaux
Les facteurs qui déclenchent les événements conduisant à la réponse auto-immune et à la pathologie articulaire qui en résulte sont encore controversés. C'est probablement l'interaction entre la susceptibilité individuelle (facteurs génétiques) et l'exposition à des facteurs environnementaux qui compromet l'immunotolérance et déclenche ainsi cette maladie complexe. (8)
La corrélation la plus importante entre la MP et le PR est associée au gène HLA-DRB1. Le rôle possible des allèles DRB1 dans la résorption de l'os alvéolaire a récemment été étudié. Gehlot et al. ont démontré que les souris transgéniques portant l'allèle codant pour le motif d'épitope partagé humain DRB1*04:01, ont une susceptibilité accrue à l'inflammation parodontale spontanée et à la destruction osseuse (9). De plus, Sandal et al. ont observé que l'exposition de la gencive des souris présentant cet allèle HLA-DR1 à Porphyromonas gingivalis entraîne une inflammation systémique avec un niveau élevé de cytokines, une diminution de la masse osseuse fémorale et une diminution de la densité osseuse (10,11).
En ce qui concerne les facteurs environnementaux, le tabagisme est significativement associé à l'incidence de la polyarthrite rhumatoïde, car non seulement il accroît la susceptibilité génétique à l'inflammation, mais il est aussi directement impliqué dans le développement d'une réponse auto-immune. En effet, les fumeurs ont un risque 1,5 à 2 fois plus élevé de présenter une polyarthrite rhumatoïde, en particulier lorsqu'ils sont également positifs à un épitope de la polyarthrite rhumatoïde. (12) Autre facteur environnemental associé au développement de la PR est l'exposition à la poussière de silice (risque relatif 3,43, intervalle de confiance 95% 2.25-5.22)(13). A l'inverse, la consommation d'alcool ou l'allaitement maternel prolongé semblent réduire le risque de développer une polyarthrite rhumatoïde (risque relatif 0,86, intervalle de confiance à 95% 0,78-0,94).
Thérapie
Étant donné le lien d’association entre les deux maladies, on suppose que le traitement efficace d'une maladie devrait prévenir ou améliorer les résultats de l'autre. Nous reviendrons ultérieurement sur les résultats des études publiées à ce sujet.
Effet du traitement parodontal sur la polyarthrite rhumatoïde
Étant donné les données de plus en plus nombreuses qui confirment l'association entre la parodontite et la polyarthrite rhumatoïde, il est plausible que le traitement parodontal puisse avoir un impact sur l'expression clinique et biochimique de la polyarthrite rhumatoïde. En effet, Lappin et al. (14) ont réalisé une thérapeutique parodontale non chirurgicale chez des patients atteints de parodontite et de polyarthrite rhumatoïde. Ils ont rapporté une diminution significative des niveaux des anticorps anti-peptides cycliques citrullinés et d'anticorps anti-Porphyromonas gingivalis 6 mois après la thérapeutique parodontale, suggérant un effet bénéfique potentiel sur l'activité de la polyarthrite rhumatoïde.
Une revue systématique avec une méta-analyse a évalué l'effet du traitement parodontal sur les sujets atteints de polyarthrite rhumatoïde (15). Cinq études identifiées ont évalué l'impact du traitement parodontal sur les paramètres cliniques et biochimiques associés à l'activité de la maladie de la polyarthrite rhumatoïde. Une réduction significative de la vitesse de sédimentation des érythrocytes et une tendance à la réduction des niveaux du facteur de nécrose tumorale-alpha, ont été démontrées après un traitement parodontal. À l'inverse, aucune réduction significative des taux de protéine C-réactive, de facteur rhumatoïde, anticorps anti-peptides cycliques ou d'interleukine-6 n'a été rapportée. (15)
Même si certaines de ces études interventionnelles ont montré une diminution de l'activité de la maladie de la polyarthrite rhumatoïde après une thérapie parodontale, il existe également des études ne rapportant aucun impact.
Effet du traitement de la polyarthrite rhumatoïde sur la parodontite
Étant donné la relation bidirectionnelle probable entre les deux maladies et le processus inflammatoire chronique, élément pathologique clé dans les deux cas, il est possible de supposer que le traitement de la polyarthrite rhumatoïde, basé sur des thérapies modulant l'hôte, peut avoir un impact significatif sur l'état parodontal des patients atteints de polyarthrite rhumatoïde et de parodontite (8).
Dans l'une des premières études sur ce principe, Pers et al. (16) ont observé que le traitement par des inhibiteurs du facteur de nécrose tumorale (TNF) alpha améliorait l'état parodontal des patients atteints de polyarthrite rhumatoïde et de parodontite. Des résultats similaires ont été rapportés lors de l'administration d'autres traitements tel que des anti-interleukine-6, anti-lymphocyte B ou des médicaments antirhumatismaux synthétiques.
Mayer et al. (17) ont évalué l'influence de l'infliximab sur la santé parodontale des patients atteints de polyarthrite rhumatoïde et l'association entre les niveaux de facteur de nécrose tumorale alpha dans le liquide créviculaire gingival et les paramètres inflammatoires parodontaux. Ils ont constaté que le traitement des patients atteints de polyarthrite rhumatoïde avec l'infliximab réduisait significativement les niveaux de facteur de nécrose tumorale- alpha dans le liquide créviculaire gingival et diminuait les paramètres inflammatoires parodontaux.
Implications pour la prévention
Dans un article éditorial, Marotte (18) a évoqué l’intérêt du traitement parodontal non chirurgical en tant qu'outil préventif et thérapeutique dans le traitement du patient atteint de polyarthrite rhumatoïde. Il a conclu que des mesures d'hygiène buccale et un traitement parodontal devraient être intégrés dans la gestion de la polyarthrite rhumatoïde et que les rhumatologues devraient s'assurer que des soins parodontaux et une évaluation de l'état parodontal à long terme sont fournis à ces sujets.
Conclusion
La parodontite a été directement associée à la polyarthrite rhumatoïde : la présence d'une inflammation parodontale et d'un nombre élevé de bactéries parodontopathogènes a été associée à l'apparition de la polyarthrite rhumatoïde et à l'augmentation de l'activité de la maladie. D'autre part, la thérapeutique parodontale non chirurgicale semble jouer un rôle dans le contrôle de l'activité de la polyarthrite rhumatoïde. À la lumière de ces données, les professionnels de santé doivent être conscients de l'importance de la santé parodontale chez les patients atteints de polyarthrite rhumatoïde. Une approche personnalisée et holistique du patient parodontal est nécessaire. Par conséquent, des efforts doivent être mis en œuvre pour prévenir et traiter les maladies parodontales chez ces patients.
L’auteur déclare ne pas avoir de liens d’intérêt en rapport avec le sujet abordé.
Bibliographie :
1. Turesson C, O’Fallon WM, Crowson CS, Gabriel SE, Matteson EL. Extra-articular disease manifestations in rheumatoid arthritis: incidence trends and risk factors over 46 years. Ann Rheum Dis [Internet]. 2003 Aug 1 [cited 2022 Jun 6];62(8):722–7. Available from: https://pubmed.ncbi.nlm.nih.gov/12860726/
2. de Molon RS, Rossa C, Thurlings RM, Cirelli JA, Koenders MI. Linkage of Periodontitis and Rheumatoid Arthritis: Current Evidence and Potential Biological Interactions. Int J Mol Sci [Internet]. 2019 Sep 2 [cited 2022 Jun 6];20(18). Available from: https://pubmed.ncbi.nlm.nih.gov/31540277/
3. Symmons DPM, Barrett EM, Bankhead CR, Scott DGL, Silman AJ. The incidence of rheumatoid arthritis in the United Kingdom: results from the Norfolk Arthritis Register. Br J Rheumatol [Internet]. 1994 Aug [cited 2022 Jun 6];33(8):735–9. Available from: https://pubmed.ncbi.nlm.nih.gov/8055200/
4. Mikuls TR, Payne JB, Yu F, Thiele GM, Reynolds RJ, Cannon GW, et al.. Periodontitis and Porphyromonas gingivalis in patients with rheumatoid arthritis. Arthritis Rheumatol (Hoboken, NJ) [Internet]. 2014 [cited 2022 Jun 6];66(5):1090–100. Available from: https://pubmed.ncbi.nlm.nih.gov/24782175/
5. Association of periodontal disease and tooth loss with rheumatoid arthritis in the US population - PubMed [Internet]. [cited 2022 Jun 6]. Available from: https://pubmed.ncbi.nlm.nih.gov/18050377/
6. Ramos-García V, Otero-Rey EM, Blanco-Carrión A. Avances en periodoncia e implantología oral. [Internet]. Vol. 28, Avances en Periodoncia e Implantología Oral. [Avances en Odontoestomatalogía]; 2016 [cited 2022 Jun 6]. 23–27 p. Available from: https://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S1699-65852016000100003&lng=es&nrm=iso&tlng=es
7. de Molon RS, Rossa C, Thurlings RM, Cirelli JA, Koenders MI. Linkage of Periodontitis and Rheumatoid Arthritis: Current Evidence and Potential Biological Interactions. Int J Mol Sci [Internet]. 2019 Sep 2 [cited 2022 Jun 7];20(18). Available from: https://pubmed.ncbi.nlm.nih.gov/31540277/
8. González-Febles J, Sanz M. Periodontitis and rheumatoid arthritis: What have we learned about their connection and their treatment? Periodontol 2000 [Internet]. 2021 Oct 1 [cited 2022 Jun 6];87(1):181–203. Available from: https://pubmed.ncbi.nlm.nih.gov/34463976/
9. Gehlot P, Volk SL, Rios HF, Jepsen KJ, Holoshitz J. Spontaneous destructive periodontitis and skeletal bone damage in transgenic mice carrying a human shared epitope-coding HLA-DRB1 allele. RMD open [Internet]. 2016 Dec 1 [cited 2022 Jun 6];2(2). Available from: https://pubmed.ncbi.nlm.nih.gov/27933212/
10. Sandal I, Karydis A, Luo J, Prislovsky A, Whittington KB, Rosloniec EF, et al.. Bone loss and aggravated autoimmune arthritis in HLA-DRβ1-bearing humanized mice following oral challenge with Porphyromonas gingivalis. Arthritis Res Ther [Internet]. 2016 Oct 26 [cited 2022 Jun 6];18(1). Available from: https://pubmed.ncbi.nlm.nih.gov/27784339/
11. Koziel J, Potempa J. Pros and cons of causative association between periodontitis and rheumatoid arthritis. Periodontol 2000 [Internet]. 2022 Jun 1 [cited 2022 Jun 6];89(1):83–98. Available from: https://pubmed.ncbi.nlm.nih.gov/35262966/
12. The effect of smoking on clinical, laboratory, and radiographic status in rheumatoid arthritis - PubMed [Internet]. [cited 2022 Jun 6]. Available from: https://pubmed.ncbi.nlm.nih.gov/10743800/
13. Khuder SA, Peshimam AZ, Agraharam S. Environmental risk factors for rheumatoid arthritis. Rev Environ Health [Internet]. 2002 [cited 2022 Jun 6];17(4):307–15. Available from: https://pubmed.ncbi.nlm.nih.gov/12611472/
14. Lappin DF, Apatzidou D, Quirke AM, Oliver-Bell J, Butcher JP, Kinane DF, et al.. Influence of periodontal disease, Porphyromonas gingivalis and cigarette smoking on systemic anti-citrullinated peptide antibody titres. J Clin Periodontol [Internet]. 2013 Oct [cited 2022 Jun 6];40(10):907–15. Available from: https://pubmed.ncbi.nlm.nih.gov/23902301/
15. Silvestre FJ, Silvestre-Rangil J, Bagan L, Bagan J V. Effect of nonsurgical periodontal treatment in patients with periodontitis and rheumatoid arthritis: A systematic review. Med Oral Patol Oral Cir Bucal [Internet]. 2016 May 1 [cited 2022 Jun 6];21(3):e349–54. Available from: https://pubmed.ncbi.nlm.nih.gov/26946202/
16. Pers J-O, Saraux A, Pierre R, Youinou P. Anti-TNF-alpha immunotherapy is associated with increased gingival inflammation without clinical attachment loss in subjects with rheumatoid arthritis. J Periodontol [Internet]. 2008 Sep [cited 2022 Jun 6];79(9):1645–51. Available from: https://pubmed.ncbi.nlm.nih.gov/18771364/
17. Mayer Y, Balbir-Gurman A, Machtei EE. Anti-tumor necrosis factor-alpha therapy and periodontal parameters in patients with rheumatoid arthritis. J Periodontol [Internet]. 2009 Sep [cited 2022 Jun 6];80(9):1414–20. Available from: https://pubmed.ncbi.nlm.nih.gov/19722791/
18. Marotte H. Non-surgical periodontal disease: A new treatment for rheumatoid arthritis? Jt bone spine [Internet]. 2020 Jan 1 [cited 2022 Jun 6];87(1):1–3. Available from: https://pubmed.ncbi.nlm.nih.gov/31153922/
