Maladies cardiovasculaires et maladies parodontales
Dossier Maladies parodontales et pathologies générales : indissociables !
AO News #51 Juillet 2022
Le microbiome, communauté bactérienne, joue un rôle essentiel dans le fonctionnement du corps humain et le maintien d’une bonne santé (Zheng et al. 2020). En ce qui concerne la flore intestinale, de nombreuses études ont montré ces dernières années que les centaines de millions de bactéries localisées dans le système digestif jouent un rôle essentiel dans le bon fonctionnement du métabolisme et du système immunitaire. A l’inverse, des phénomènes de dysbiose, c’est-à-dire de déséquilibre dans la composition du microbiome, créent une dérégulation de l’écosystème bactérien en association avec le développement de plusieurs maladies chroniques (Kitamoto et al. 2022, Gilbert et al. 2018).
On peut aisément faire le lien avec la cavité orale et son impact sur la santé générale. De nombreuses études ont mis en évidence une communication étroite entre la cavité orale et le reste du corps, comme par exemple le foie, via la circulation sanguine et les échanges métaboliques entraînant des translocations bactériennes (Albuquerque-Souza et al. 2022, Alakhali MS et al. 2018). La cavité orale représente la communauté bactérienne la plus importante dans l’organisme après la flore intestinale, abritant plus de 770 espèces bactériennes différentes (Escapa et al. 2018), 1ml de salive contenant près de 100 millions de cellules bactériennes (Curtis et al. 2011). Les maladies parodontales ont un grand impact sur la symbiose ou l’équilibre de l’écosystème de l’organisme car ce sont des maladies inflammatoires chroniques multifactorielles directement associées à une dysbiose bactérienne, caractérisées par une atteinte partielle ou totale des tissus de soutien de la dent pouvant aboutir à la perte des dents (Papapanou et al., 2018). La World Heart Federation, société scientifique de référence dans le domaine des pathologies cardiovasculaires, a établi pour la première fois en 2020, en association avec l’European Federation of Periodontology (EFP), un consensus prouvant le lien entre maladies parodontales et pathologies cardiovasculaires (Sanz M et al., 2020). Le but de cet article est de mesurer l’immense impact des parodontites sur le risque de maladies cardiovasculaires, en explorant les données épidémiologiques récentes et les mécanismes biologiques impliqués.
Épidémiologie
Depuis les 25 dernières années, la proportion de maladie cardiovasculaire (MCV) a fortement augmenté en raison du vieillissement de la population. En Europe, les maladies cardio-vasculaires sont responsables de 3,9 millions de morts (45% des décès) (Wilkins et al. 2017). Les cardiopathies ischémiques, les accidents vasculaires cérébraux (AVC), l’hypertension menant à l’insuffisance cardiaque, les cardiopathies rhumatismales, les cardiomyopathies et la fibrillation atriale (voir encadré), sont responsables de plus de 95% des décès dus aux MCV (Roth et al. 2015). Toute perturbation de l’endothélium vasculaire majore le risque cardiovasculaire. Ainsi, les facteurs de risque principaux des MCV concernent le mode de vie sédentaire, l’alimentation, le tabac, la dyslipidémie, l’hypertension et le diabète, ainsi que la présence de toute maladie chronique inflammatoire comme la polyarthrite rhumatoïde, le psoriasis, le lupus érythémateux ou la parodontite. Le stress oxydatif et l’inflammation (Sécrétion d’Interleukine 1 et TNF alpha) contribuent à des changements endothéliaux.
Les maladies parodontales sont aujourd’hui la 6ème maladie la plus fréquente chez l’homme affectant 45 à 50% de la population, 11,2% pour les formes les plus sévères. (Kassebaum et al. 2014). La parodontite est une maladie inflammatoire chronique provoquant une augmentation des médiateurs de l’inflammation comme la protéine C-réactive, les métalloprotéases matricielles et le fibrinogène (Scheinkein et al. 2020) impliqués dans le risque plus élevé de MCV. Une étude épidémiologique récente (Yan et al. 2022) montre que le risque d’insuffisance cardiaque est trois fois plus élevé chez les populations présentant une parodontite modérée à sévère non traitée.
Quelques définitions générales des maladies cardiovasculaires par le Dr Émilie Varlet, cardiologue à l’Hôpital Européen Georges Pompidou
La cardiopathie ischémique est une atteinte cardiaque liée à une maladie des artères coronaires qui assurent la vascularisation du tissu myocardique. Ces artères sont le siège d'une athérosclérose avec sténose plus ou moins serrée d'une ou plusieurs des trois artères qui irriguent le cœur. Le défaut d'oxygénation aigu (dans le cadre de l'infarctus du myocarde) ou chronique (avec des sténoses serrées sans occlusion complète) entraîne une insuffisance cardiaque plus ou moins sévère par fibrose ou ischémie du tissu myocardique.
L'AVC ischémique est le résultat d'un caillot sanguin qui part dans la circulation des vaisseaux qui irriguent le cerveau et qui, en bouchant un de ces vaisseaux, entraîne une ischémie cérébrale dans un territoire localisé, avec des signes neurologiques en rapport avec le territoire atteint. La séquelle neurologique sera plus ou moins importante selon le délai de prise en charge de la revascularisation et le territoire atteint. L'AVC hémorragique est le résultat d'un saignement dans le cerveau du fait d'un vaisseau qui "éclate". Il peut être post traumatique, spontané, lié à un surdosage de traitement anticoagulant, post AVC ischémique…
L'hypertension artérielle est une élévation trop importante de la pression dans les artères. Elle peut mener à l'insuffisance cardiaque si elle est mal contrôlée ou non traitée en augmentant le travail du cœur qui doit lutter à chaque pulsation pour éjecter le sang dans l'aorte. Le cœur va s'hypertrophié dans un premier temps puis se dilater dans un deuxième temps et entraîner une insuffisance cardiaque.
La cardiopathie rhumatismale est l'ensemble des atteintes cardiaques liées au rhumatisme articulaire aigu qui sévit essentiellement dans les pays en voie de développement. Elle atteint essentiellement les valves cardiaques (mitrale et aortique surtout, rétrécissement et/ou insuffisance valvulaire). Il s'agit d'une réaction inflammatoire auto-immune liée aux atteintes mal soignées de la gorge par le streptocoque du groupe A.
La fibrillation atriale est un trouble du rythme lié à une activité électrique anarchique et rapide dans les oreillettes. La contraction des oreillettes est ainsi désorganisée et inefficace, suivie par la contraction irrégulière et rapide des ventricules. Du fait de la mauvaise contraction des oreillettes, un thrombus peut se créer et partir dans la circulation, entraînant ainsi un AVC. La contraction rapide des ventricules peut être ressentie par des palpitations et peut parfois entraîner de l'insuffisance cardiaque.
Le dernier consensus de 2020 (Sanz et al. 2020) met en évidence plusieurs points (Dietrich et al. 2013) :
les patients atteints de parodontite ont une prévalence plus haute de maladies coronariennes, d’infarctus du myocarde, de cardiopathies ischémiques ;
à l’inverse, les maladies cardiovasculaires comme facteur de risque des maladies parodontales ont encore une preuve scientifique limitée.
Athérosclérose et anévrysme de l’aorte abdominale
L’anévrysme de l’aorte abdominale (AAA) est une maladie dégénérative chronique de l'aorte abdominale favorisée par des facteurs de risque génétiques et environnementaux tels que le tabagisme, l'âge avancé, l'origine ethnique caucasienne et le sexe masculin. La maladie progresse avec l'augmentation du diamètre de l'aorte abdominale qui peut conduire à la rupture du vaisseau. La physiopathologie des AAA implique une destruction inflammatoire de la structure de la paroi aortique externe (l’adventice) et la présence d'un thrombus intraluminal pouvant être induit par la présence de plusieurs bactéries (Sahli et al. 2022).
L'athérosclérose est un groupe d'états pathologiques dans lesquels les artères musculaires et élastiques de grande taille à moyenne taille deviennent occluses par des lésions fibrolipidiques, appelées athéromes au niveau de l’intima du vaisseau (paroi interne). La rupture des plaques d'athérome peut entraîner des événements en phase terminale, notamment une thrombose coronarienne, un infarctus aigu du myocarde et un accident vasculaire cérébral (Reyes et al. 2013, Scheinkein et al. 2020) (Fig. 1, 2).
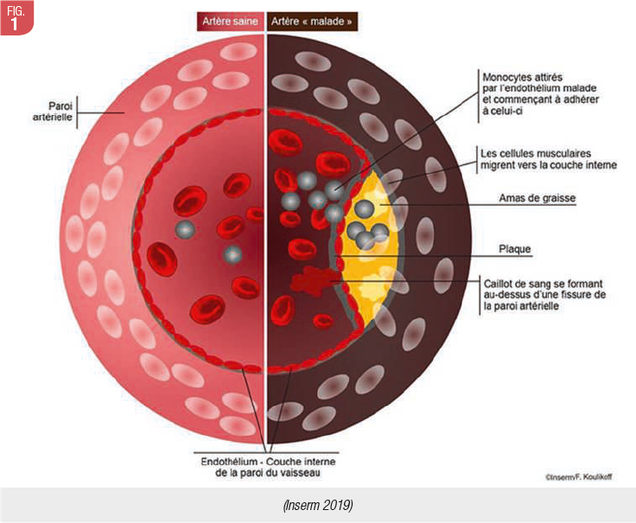
L’athérosclérose se caractérise par le dépôt d’une plaque essentiellement composée de lipides (athérome) sur la paroi interne des artères (intima). Ces plaques peuvent entrainer la lésion de la paroi artérielle (sclérose), conduire à l’obstruction du vaisseau, ou encore se rompre, avec des conséquences souvent dramatiques. Les pathologies liées à l’athérosclérose résultent le plus souvent de la rupture d’une plaque d’athérome, provoquant une agrégation plaquettaire et la formation d’un thrombus. Cela se produit sur des décennies. Au début asymptomatique, la lésion passe par plusieurs stades d’accumulation de lipides extra-cellulaires, pouvant mener à un thrombus. L’athérosclérose passe par 3 stades : initiation (dysfonction endothéliale), maturation et rupture de la plaque d’athérome (thrombus).
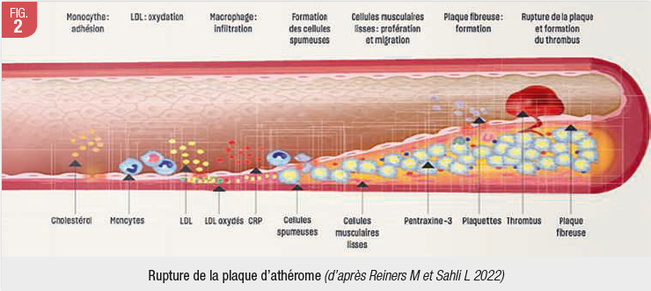
A l’intérieur de la plaque, la production de MMP, cytokines (TNF, et interleukine 1 et 6), dérivés réactifs de l’oxygène et du facteur tissulaire (FT) est augmentée. Le FT induit la dégradation de la matrice extracellulaire et entraîne la rupture de la plaque d’athérome et la formation de thrombus.
Mécanismes microbiologiques : bactériémie
Les deux principaux mécanismes influant sur les MCV sont la bactériémie (diffusion des bactéries dans le sang) et l’élévation du taux de protéine C-réactive (CRP) et du stress oxydatif entraînant une surexpression des médiateurs de l’inflammation (Mascari 2021).
Dès 2007, il a été montré que les MCV et les maladies parodontales avaient des bactéries anaérobies communes (Atarbashi-Moghadam et al. 2018). Ces pathogènes augmentent le risque d’agrégation plaquettaire pouvant alors induire des évènements thrombo-emboliques. Les bactéries impliquées dans les MCV et les parodontites sont Porphyromonas gingivalis, Aggregatibacter actinomycetemcomitans et Tannerella forsythia (Froum et al. 2021). Dès 2005, il a été montré que Porphyromonas gingivalis et Aggregatibacter actinomycetemcomitans sont présentes dans les plaques d’athérome (Korazov et al. 2005).
Les bactéries pénètrent dans l’intima des vaisseaux et envahissent les cellules endothéliales, les cellules musculaires lisses, les leucocytes et les plaquettes et contribuent à l’agrégation plaquettaire. Des modèles animaux et in vitro ont en effet mis en évidence que les parodontopathogènes (P gingivalis, A actinomycetemcomitans, etc) favorisent la formation de plaque d’athérome et peuvent induire des signaux inflammatoires augmentant le stress oxydatif au niveau des cellules endothéliales aortiques (Velsko et al. 2015)
Une récente revue narrative dresse un panorama de la littérature scientifique depuis la fin des années 1990 à nos jours, et met en évidence sept hypothèses différentes de l’interaction microbiologique entre parodontite et athérosclérose (Herrera et al. 2020).
- Les parodontopathogènes peuvent atteindre les tissus vasculaires : différents mécanismes de dissémination ont été proposés (mécanismes transcellulaires et perturbations physiques des tissus parodontaux par le brossage, les détartrage-sufaçages, les extractions, etc… aboutissant à la diffusion des bactéries dans les tissus vasculaires.)
- Les parodontopathogènes ont été retrouvés dans les tissus affectés : différentes espèces bactériennes de la cavité orale ont été identifiées dans les plaques d’athérome par recherche ADN, ARN ou antigénique. Des études avec des technologies de séquençage de masse plus avancées ont montré que les patients atteints de parodontites présentent un plus grand risque d’athérosclérose (Armingohar Z 2014)
- Les parodontopathogènes Porphyromonas gingivalis et Aggregatibacteur actinomycetemcomitans ont été identifiés in vivo dans les tissus athéromateux (Kozarov et al. 2005)
- Les premières études in vitro qui montrent l’invasion de P gingivalis dans les cellules endothéliales datent de la fin des années 1990 (Desphande et al. 1998)
- Des modèles animaux ont montré que les parodontopathogènes induisent la formation de plaque d’athérome : chez le porc, la bactériémie par P gingivalis récurrente induit des lésions aortiques et coronariennes (Brodala et al. 2005). Une étude plus récente chez la souris montre « qu’une infection buccale chronique à P. gingivalis entraîne une réponse immunitaire spécifique, une augmentation significative de la résorption osseuse parodontale, une inflammation aortique, des bactéries dans l'épithélium buccal et dans l'aorte et le développement de la plaque » (Velsko et al. 2014). Ils démontrent ainsi le mécanisme de la réponse inflammatoire aortique de l'hôte induite par une infection polymicrobienne avec des pathogènes parodontaux bien caractérisés (Velsko et al. 2015)
- Les espèces bactériennes mutantes non invasives présentent beaucoup moins de risques reliés à l’athérosclérose (Reyes et al. 2013)
- Les parodontopathogènes isolés à partir des plaques d’athérome d’humains sont inoculés à des animaux et engendrent une athérosclérose (Rafferty et al. 2011)
Mécanismes inflammatoires responsables de l’association entre maladies parodontales et maladies cardiovasculaires
Un autre mécanisme possible augmentant le risque cardiovasculaire concerne la circulation systémique de cytokines et des médiateurs de l’inflammation à cause d’une maladie parodontale.
Dans les parodontites, les destructions des tissus mous et des tissus durs sont surtout causées par la réponse inflammatoire de l’hôte à la colonisation par les germes pathogènes gram- organisés en biofilm. Les lipopolysaccharides (LPS), composants majeurs de la membrane externe des bactéries gram- initient la cascade d’événements conduisant à la destruction des tissus parodontaux (Pussinen et al. 2022). Les leucocytes polymorphonucléaires (PMN) sont recrutés sur le site et les monocytes et les macrophages activés répondent en libérant des cytokines pro-inflammatoires comme l’interleukine IL1 et Tumor Necrosing Factor TNF alpha, qui activent le processus de destruction. À ce stade, les fibroblastes, les macrophages et les PMN vont libérer des enzymes, médiateurs de la résorption osseuse, des metalloprotéinases (les MMPs). Ces enzymes protéolytiques sont impliquées dans la dégradation de la matrice extracellulaire au cours de processus physiologiques et pathologiques (remodelage osseux, résorption et formation osseuse).
Concernant l’athérosclérose, l’augmentation de la concentration de cytokines et de médiateurs de l’inflammation circulant peut endommager l’endothélium vasculaire . Le taux de CRP, plus haut chez les patients atteints de parodontite, notamment à cause de la présence en grande quantité de Porphyronomas gingivalis, est considéré comme un marqueur de l’athérosclérose (Froum et al. 2021).
Plusieurs mécanismes différents sont décrits dans l’interaction inflammatoire en maladies parodontales et maladies cardiovasculaires (Herrera et al. 2020).
La réponse inflammatoire aux parodontopathogènes n’est pas seulement limitée à la lésion parodontale où se produit une augmentation locale de cytokines inflammatoires et d’autres médiateurs du fluide gingival, mais affecte également d’autres sites du corps. La présence élevée de marqueurs de l’inflammation (protéine C réactive, interleukines, métalloprotéases) est associée à un risque cardiovasculaire plus important. Les maladies cardiovasculaires se caractérisent par des taux sériques élevés de cytokines. Une étude cas-témoin de Widén et al. 2016 a évalué deux cohortes de patients atteints de syndrome coronarien aigu et témoins, montrant une prévalence beaucoup plus élevée de parodontite chez les sujets atteints de maladies cardiovasculaires que chez les témoins (52,6 % contre 12,8 %).
Les métalloprotéases semblent jouer un rôle important dans la rupture de la plaque d’athérome. Ce sont des enzymes impliqués dans la régulation du métabolisme du tissu conjonctif. Les lésions parodontales sont associées à une destruction du tissu conjonctif et interférent donc sur le taux de metalloprotéases.
L’oxyde nitrique est un vasodilatateur naturel produit par les cellules endothéliales et les plaquettes qui régulent la fonction endothéliale. Une augmentation du stress oxydatif comme résultat d’une inflammation influe directement sur la quantité d’oxyde nitrique. Traiter l’inflammation, et donc réduire le taux d’oxyde nitrique contribue à améliorer le taux d’oxyde nitrique et favorise de meilleures défenses anti-oxydante contre l’athérosclérose. (Machado et al. 2021)
Les facteurs thrombotiques et hémostatiques influent sur l’inflammation : Les événements thrombotiques et l'agrégation plaquettaire jouent un rôle majeur dans l'étiopathogénie des maladies cardiovasculaires, depuis le développement de la plaque d’athérome jusqu'à la survenue d'événements indésirables. Un déséquilibre entre la coagulation et la fibrinolyse peut entraîner un état prothrombotique et un dysfonctionnement endothélial. Plusieurs facteurs hémostatiques ont été associés à l'initiation et à la promotion de l'athérosclérose, notamment le fibrinogène, le facteur von Willebrand, l'activateur tissulaire du plasminogène et les plaquettes (Schenkein et al. 2020, et 2013). Un taux sérique élevé de fibrinogène augmente la viscosité sanguine et encourage la formation de thrombus. Chez les patients atteints de parodontites, les taux de fibrinogène sont élevés. Le traitement parodontal diminue le taux sérique de fibrinogène et de protéine C-reactive ( Lopez et al. 2012)
Les anticorps : des taux élevés d'immunoglobuline G (IgG) contre P. gingivalis sont courants chez les patients atteints de parodontite. Aoyama et al. 2018 ont montré que les patients diagnostiqués avec une maladie cardiovasculaire ont également des taux élevés d'IgG contre les antigènes de surface cellulaire de parodontopathogènes tels que P. gingivalis, A. actinomycetemcomitans et Prevotella intermedia. Liljestrand et al. 2018 a présenté l’étude de cohorte Parogene sur sous-échantillon de 505 sujets de l'étude de cohorte Corogene, qui comprend un total de 5297 patients finlandais ayant subi une coronarographie. Les sujets de l'étude Parogene ont été soumis à des examens cliniques et radiographiques complets de leur état parodontal et à un prélèvement microbien sous-gingival. Les données ont corroboré la présence de niveaux plus élevés d'immunoglobuline A (IgA) et d'anticorps IgG sériques pour A. actinomycetemcomitans, P. gingivalis, Porphyromonas endodontalis, P. intermedia, T. forsythia, Campylobacter rectus et F nucleatum chez les patients atteints de parodontite mais il a également démontré une association entre la charge d'anticorps et la prévalence de sujets atteints de syndrome coronarien aigu.
Les facteurs de virulence et les virus : P. gingivalis exprime plusieurs facteurs de virulence tels que l’hemaglutinine A, qui jouent un rôle important dans la fixation bactérienne et l'invasion des cellules hôtes. Des expériences in vitro ont montré que certaines souches bactériennes de P. gingivalis, telles que Salmonella enterica, ont une capacité accrue à adhérer et à envahir les cellules endothéliales de l'artère coronaire humaine suggérant que l'hémagglutinine A pourrait aider P. gingivalis à envahir les tissus vasculaires.
La dyslipidémie concerne des niveaux anormaux de lipides (triglycérides et cholestérol principalement) dans le sang, l'hyperlipidémie étant sa forme la plus courante, en particulier dans les pays développés. De faibles niveaux de cholestérol à lipoprotéines de haute densité (HDL), des concentrations élevées de cholestérol à lipoprotéines de basse densité (LDL) et de triglycérides sont bien établis comme prédicteurs indépendants du risque de maladie cardiovasculaire. Les changements induits par l'infection dans le profil lipidique peuvent être un mécanisme sous-jacent au risque accru d'athérosclérose chez les patients atteints d'infections chroniques (Schenkein et al. 2020).
L'adiponectine est une protéine circulante produite par les adipocytes qui régule le métabolisme des lipides et du glucose et joue un rôle protecteur dans le développement et la progression des lésions d'athérosclérose, en raison de ses propriétés anti-inflammatoires. Les patients diagnostiqués avec un infarctus aigu du myocarde présentent des taux circulants d'adiponectine significativement plus faibles que les patients sains. Il a été observé que les taux salivaires et sériques d'adiponectine étaient augmentés chez les sujets ayant une meilleure santé bucco-dentaire et un nombre de dents plus élevé, ce qui suggère qu'une santé bucco-dentaire adéquate peut favoriser la production d'adiponectine et son rôle protecteur en tant qu'anti- inflammatoire (Ebersole et al. 2017)
Facteurs génétiques impliqués dans l’inflammation : l'hypothèse selon laquelle il pourrait y avoir un fond génétique commun qui prédisposerait certains patients à aux maladies inflammatoires telles que la parodontite et les maladies cardiovasculaires pourrait suggérer un mécanisme de liaison alternatif entre les deux maladies. Selon Aarabi et al. 2017, des études à l'échelle du génome ont détecté plus de 50 gènes candidats impliqués dans la pathogenèse des maladies cardiovasculaires. Parmi eux, trois variantes génétiques ont été identifiées pour partager une association significative avec les parodontites. Les recherches au sujet des facteurs génétiques prédisposants méritent encore d’autres investigations.
Cependant, même si l'inflammation joue un rôle majeur dans l’étiopathogénie des maladies parodontales et cardiovasculaires, plusieurs facteurs de risque sont communs aux deux pathologies, comme le tabac et certaines habitudes de vie. Il est recommandé de contrôler les éventuels facteurs confondants, car leur présence peut conduire à une surestimation de l'association observée dans les études entre les autres marqueurs des maladies étudiés.
Contrôler l’inflammation au niveau parodontal pour permettre une bonne santé bucco-dentaire paraît donc indispensable. Le taux de CRP (protéine C reactive) est plus élevé chez les patients atteints de parodontite par rapport aux patients sains. Les effets du traitement parodontal montrent une association entre contrôle de l’inflammation parodontale, forte diminution du taux de CRP et amélioration de la santé cardio-vasculaire (Demmer et al. 2013, Machado et al. 2021))
Les effets du traitement parodontal
Concernant la prévention primaire, une étude prospective basée sur la population utilisant des données de Système national d'assurance maladie (Cohorte nationale de dépistage de la santé, dont 247 696 participants indemnes de tout antécédent cardiovasculaire recrutés entre 2002 et 2003), a montré qu'une augmentation du nombre de lésions carieuses dentaires, la présence de parodontite et un plus grand nombre de dents perdues étaient associés à un risque accru de futurs événements cardiovasculaires majeurs (décès, infarctus aigu du myocarde, insuffisance cardiaque et accident vasculaire cérébral) (Park et al.., 2019). Un brossage de dents supplémentaire par jour et le nettoyage prophylactique régulier chez un professionnel est associé à une incidence réduite d'événements cardiovasculaires.
A l’inverse, les preuves directes des effets du traitement parodontal sur l’amélioration des paramètres cardiovasculaires tels que la tension artérielle et les fonctions endothéliales restent encore cependant limitées (Sanz et al. 2020). D’autres études sont nécessaires.
Le rôle des statines dans la prévention des maladies cardiovasculaires via la diminution du LDL cholestérol a été étudié. Certains travaux ont cherché à montrer le bénéfice des statines dans le traitement de maladies parodontales, laissant entendre que les patients sous statines auraient un risque de parodontite plus faible. Deux méta-analyses récentes n’ont pas pu mettre en évidence ce rôle positif (Sanz et al. 2020, Muniz et al. 2018).
Concernant l’augmentation du risque cardiovasculaire suite à un traitement parodontal non chirurgical, le groupe d’experts a conclu à l’absence de risque. De même, chez les patients avec un risque cardiovasculaire, le traitement parodontal peut être mené sans augmenter ce risque, dans le respect des recommandations professionnelles. A noter néanmoins que la full-mouth therapy (détartrage-surfaçage radiculaire en 24h de la bouche complète) peut activer une réponse inflammatoire systémique avec une dysfonction endothéliale transitoire. L’effet à distance sur les cellules endothéliales n’est pas observé quand le traitement parodontal se déroule par quadrant en plusieurs séances espacées, avec un nombre de dents surfacées limité à chaque séance (Graziani et al. 2015). (Fig.3)
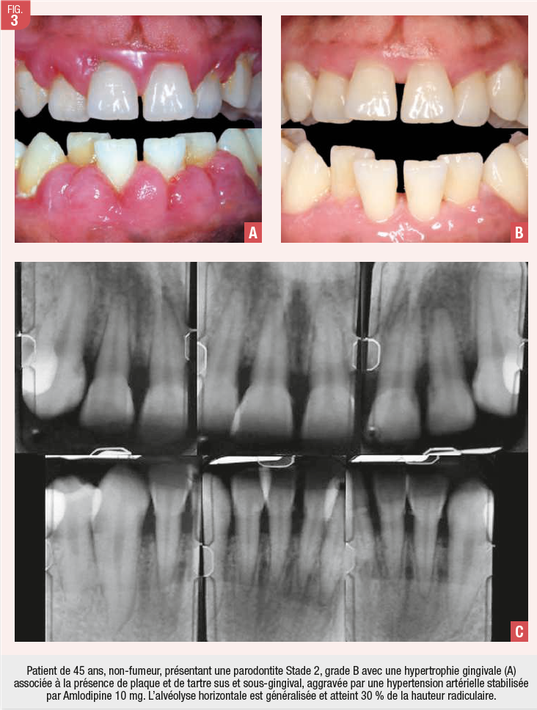
L’amlodipine est un inhibiteur calcique prescrit en cas d’hypertension artérielle. Les effets secondaires de cette molécule peuvent être l’aggravation de l’inflammation gingivale et l’apparition d’hypertrophie gingivale. Dans ce cas, un changement de molécule est demandé au médecin traitant en concomittance avec la thérapeutique étiologique. L’amlodipine est remplacée par le coversyl, inhibiteur de l’angiotensine II. La thérapeutique étiologique a été réalisée en 4 séances rapprochées. La réévaluation a eu lieu 8 semaines après la dernière séance de surfaçage. On remarque la forte diminution de l’inflammation, ce qui diminue le risque d’évènements cardiovasculaires indésirables.
Recommandations issues du dernier consensus de 2020 (Sanz et al. 2020)
Les patients atteints de parodontites doivent être informés d’un risque plus élevé de maladie cardiovasculaire et doivent tenter de contrôler les facteurs de risque tels le tabac, l’alimentation, le suivi parodontal.
Les patients présentant un risque cardiovasculaire doivent avoir une bonne hygiène bucco-dentaire, se brosser les dents deux fois par jour, des visites prophylactiques régulières.
Les patients sous anti-aggregant plaquettaire et sous anti-vitamine K n’ont pas besoin d’arrêter leur traitement lors d’une prise en charge parodontale.
Conclusion
Un risque accru d'AVC est associé à la présence de parodontite sévère (Sen et al. 2018). De nombreuses études rapportent une influence significative du traitement parodontal sur les marqueurs des événements cardiovasculaires. Le traitement parodontal déclenche une courte réponse inflammatoire, suivi d’une réduction de l'inflammation systémique ainsi qu'une amélioration de la fonction endothéliale, diminuant le risque de maladie cardiovasculaire. Des soins dentaires réguliers sont associés à un risque cardiovasculaire plus faible. Le traitement des maladies parodontales semble donc avoir la possibilité d'affecter également les maladies systémiques, comme les maladies cardiovasculaires. Prendre en charge sur le plan parodontal un patient atteint de parodontite sévère nécessite une visite de contrôle chez un médecin, dans le but de dépistage d’un éventuel risque cardiovasculaire.
Les maladies parodontales et l’athérosclérose partagent plusieurs mécanismes d'inflammation systémique en commun. L'infection parodontale peut influencer la formation et la progression de la plaque d'athérome par une voie directe dirigée par la bactériémie et l'invasion bactérienne de sites distants, et une voie indirecte consistant en des niveaux accrus de médiateurs inflammatoires systémiques, de lipides et de facteurs hémostatiques et thrombotiques. Cependant, l'ampleur exacte de l'effet que les maladies parodontales ont sur la progression de l’athérosclérose reste à étudier de façon plus précise. Du point de vue épidémiologique, il est prouvé qu'il existe une association entre la parodontite et les maladies cardiovasculaires, comme le démontrent de multiples études transversales et longitudinales, et cette relation semble être indépendante des autres facteurs de risque classiques. (Herrera et al. 2020, Sanz et al. 2020) De nouvelles preuves suggèrent une association directe entre la gravité de la parodontite et un risque plus élevé d'accident vasculaire cérébral (Sen et al. 2018). Le traitement parodontal a démontré qu'il réduisait les médiateurs inflammatoires sériques et qu’il induisait des changements positifs pour d'autres marqueurs des maladies cardiovasculaires.
Bibliographie
Aarabi G, Zeller T, Seedorf H, et al.. Genetic susceptibility contributing to periodontal and cardiovascular disease. J Dent Res. 2017;96(6):610-617.
Albuquerque-Souza E, Sahingur SE, Periodontitis, chronic liver diseases, and the emerging oral-gut-liver axis, Periodontol 2000. 2022 Jun;89(1):125-141. D
Alakhali MS, Al-Maweri SA, Al-Shamiri HM, Al-Haddad K, Halboub E. The potential association between periodontitis and non-alcoholic fatty liver disease: a systematic review. Clin Oral Investig. 2018;22:2965-2974.
Aoyama N, Suzuki JI, Kobayashi N, et al.. Associations among tooth loss, systemic inflammation and antibody titers to periodontal pathogens in Japanese patients with cardiovascular disease. J Periodontal Res. 2018;53(1):117-122.
Armingohar Z, Jørgensen JJ, Kristoffersen AK, Abesha-Belay E, Olsen I. Bacteria and bacterial DNA in atherosclerotic plaque and aneurysmal wall biopsies from patients with and without periodontitis. J Oral Microbiol. 2014;6:23408.
Atarbashi-Moghadam F, Havaei SR, Havaei SA, Hosseini NS, Behdadmehr G, Atarbashi-Moghadam S. Periopathogens in atherosclerotic plaques of patients with both cardiovascular disease and chronic periodontitis. ARYA Atheroscler 2018;14:53–57.
Brodala N, Merricks EP, Bellinger DA, et al.. Porphyromonas gingivalis bacteremia induces coronary and aortic atherosclerosis in normocholesterolemic and hypercholesterolemic pigs. Arterioscler Thromb Vasc Biol. 2005;25(7):1446-1451.
Curtis MA, Zenobia C, Darveau RP, the relationship of the oral microbiotia to periodontal health and disease, Cell Host Microbe. 2011 Oct 20; 10(4): 302–306.
Demmer R. T., Trinquart L., Zuk A., Fu B. C., Blomkvist, J., Michalowicz, B. S., Desvarieux, M. The influence of anti‐infective periodontal treatment on C‐reactive protein: A systematic review and meta‐analysis of randomized controlled trials, 2013. PLoS ONE, 8, e77441
Deshpande RG, Khan MB, Genco CA. Invasion of aortic and heart endothelial cells by Porphyromonas gingivalis. Infect Immun. 1998;66(11):5337-5343.
Escapa IF, Chen T, Huang Y, Gajare P, Dewhirst FE, Lemon KP. New insights into human nostril microbiome from the expanded human oral microbiome database (eHOMD): a resource for the microbiome of the human aerodigestive tract. mSystems. 2018;3(6):00187–18.
Dietrich, T., Sharma, P., Walter, C., Weston, P., & Beck, J. The epidemiological evidence behind the association between periodontitis and incident atherosclerotic cardiovascular disease, 2013 Journal of Clinical Periodontology, 40, S70–84.
Ebersole JL, Kryscio RJ, Campbell C, et al.. Salivary and serum adiponectin and C-reactive protein levels in acute myocardial infarction related to body mass index and oral health. J Periodontal Res. 2017;52(3):419-427.
Froum SJ, Hengjeerajaras P, Liu KY, Maketone P, Patel V, Shi Y. The Link Between Periodontitis/Peri-implantitis and Cardiovascular Disease: A Systematic Literature Review. Int J Periodontics Restorative Dent. 2021 Nov/Dec;40(6):e229-e233.
Gilbert JA, Blaser MJ, Caporaso JG, Jansson JK, Lynch SV, Knight R. Current understanding of the human microbiome. Nat Med. 2018;24(4):392-400.
Graziani, F., Cei, S., Orlandi, M., Gennai, S., Gabriele, M., Filice, N., D'Aiuto, F. Acute‐phase response following full‐mouth versus quadrant non‐surgical periodontal treatment: A randomized clinical trial, 2015, Journal of Clinical Periodontology, 42, 843–852
Herrera D, Molina A, Buhlin K, Klinge B. Periodontal diseases and association with atherosclerotic disease. Periodontol 2000. 2020 Jun;83(1):66-89.
Inserm 2019, Athérosclérose, une évolution lente, mais parfois dramatique, Dossier réalisé en collaboration avec Alain Tedgui, Grand Prix Inserm 2018, Paris-Centre de recherche Cardiovasculaire (PARCC), unité 970 Inserm/Université Paris Descartes
Kassebaum, N. J., Bernabe, E., Dahiya, M., Bhandari, B., Murray, C. J.,& Marcenes, W, Global burden of severe periodontitis in 1990–2010: A systematic review and meta‐regression. Journal of Dental Research 2014, 93, 1045–1053
Kitamoto S, Kamada N. Periodontal connection with intestinal inflammation: Microbiological and immunological mechanisms. Periodontol 2000. 2022 Jun;89(1):142-153.
Kozarov, E. V., Dorn, B. R., Shelburne C. E., Dunn, W. A. Jr, & Progulske‐Fox. A, Human atherosclerotic plaque contains viable invasive Actinobacillus actinomycetemcomitans and Porphyromonas gingivalis. Arteriosclerosis, Thrombosis, and Vascular Biology,2005, 25, e17–18.
Liljestrand JM, Paju S, Pietiainen M, et al.. Immunologic burden links periodontitis to acute coronary syndrome. Atherosclerosis. 2018;268(January):177-184.
López NJ, Quintero A, Casanova PA, Ibieta CI, Baelum V, Lopez R. Effects of periodontal therapy on systemic markers of inflammation in patients with metabolic syndrome: a controlled clinical trial. J Periodontol. 2012;83(3):267-278.
Machado V, Botelho J, Escalda C, Hussain SB, Luthra S, Mascarenhas P, Orlandi M, Mendes JJ, D'Aiuto F. Serum C-Reactive Protein and Periodontitis: A Systematic Review and Meta-Analysis. Front Immunol. 2021 Jul 28;12:706432.
Mascari R, Vezzeti A, Orofino C, Byrd A, Hicklin D, Nichols C, Curtis J, Sen S. Periodontal Disease Association with Large-Artery Atherosclerotic Stroke. J Neurol Disord Stroke. 2021;8(1):1173.
Muniz, F., Taminski, K., Cavagni, J., Celeste, R. K., Weidlich, P., & Rosing, C. K.. The effect of statins on periodontal treatment-a systematic review with meta‐analyses and meta‐regression. 2018, Clinical Oral Investigations, 22, 671–687
Papapanou PN, Sanz M, Buduneli N, Dietrich T, Feres M, Fine DH, et al.. Periodontitis: Consensus report of workgroup 2 of the 2017 World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions. J Periodontol. 2018 Jun;89 Suppl 1:S173-82
Park, S. Y., Kim, S. H., Kang, S. H., Yoon, C. H., Lee, H. J., Yun, P. Y., … Chae, I. H.. Improved oral hygiene care attenuates the cardiovascular risk of oral health disease: A population‐based study from Korea , 2019, European Heart Journal, 40, 1138–1145.
Pussinen PJ, Kopra E, Pietiäinen M, Lehto M, Zaric S, Paju S, Salminen A. Periodontitis and cardiometabolic disorders: The role of lipopolysaccharide and endotoxemia. Periodontol 2000. 2022 Jun;89(1):19-40.
Rafferty B, Jönsson D, Kalachikov S, et al.. Impact of monocytic cells on recovery of uncultivable bacteria from atherosclerotic lesions. J Intern Med. 2011;270(3):273-280.
Reiners M, Sahli L, Parodontites et maladies cardiovasculaires, Information dentaire, mars 2022, 13 : 62-68.
Reyes L, Herrera D, Kozarov E, Roldá S, Progulske-Fox A. Periodontal bacterial invasion and infection: contribution to atherosclerotic pathology. J Periodontol. 2013 Apr;84(4 Suppl):S30-50.
Roth, G. A., Forouzanfar, M. H., Moran, A. E., Barber, R., Nguyen, G., Feigin, V. L., … Murray, C. J. Demographic and epidemiologic drivers of global cardiovascular mortality, New England Journal of Medicine 2015, 372 : 1333–1341.
Salhi L, Rijkschroeff P, Van Hede D, Laine ML, Teughels W, Sakalihasan N, Lambert F. Blood Biomarkers and Serologic Immunological Profiles Related to Periodontitis in Abdominal Aortic Aneurysm Patients. Front Cell Infect Microbiol. 2022 Jan 14;11
Sanz M, Marco Del Castillo A, Jepsen S, Gonzalez-Juanatey JR, D'Aiuto F, Bouchard P, Chapple I, Dietrich T, Gotsman I, Graziani F, Herrera D, Loos B, Madianos P, Michel JB, Perel P, Pieske B, Shapira L, Shechter M, Tonetti M, Vlachopoulos C, Wimmer G. Periodontitis and cardiovascular diseases : Consensus report. J Clin Periodontol 2020 ; 47 (3) : 268-88.
Sen S, Giamberardino LD, Moss K, et al.. Periodontal disease, regular dental care use, and incident ischemic stroke. Stroke. 2018;49(2):355-362.
Schenkein HA, Loos BG. Inflammatory mechanisms linking peri- odontal diseases to cardiovascular diseases. J Clin Periodontol. 2013;40(Suppl 14):S51-S69.
Schenkein, H. A., Papapanou, P. N., Genco, R., & Sanz, M, Mechanisms underlying the association betweem periodontitis and atherosclerotic disease. Periodontol 2000. 2020 Jun;83(1):90-106.
Tonetti MS, Van Dyke TE. working group 1 of the joint EFP/AAP. Periodontitis and atherosclerotic cardiovascular disease: consensus report of the Joint EFP/AAP workshop on periodontitis and systemic diseases. J Periodontol. 2013;84:S24–29.
Van Dyke TE, Kholy KE, Ishai A, et al.. Inflammation of the periodontium associates with risk of future cardiovascular events. J Periodontol. 2021; 92: 348- 358.
Velsko IM, Chukkapalli SS, Rivera MF, et al.. Active invasion of oral and aortic tissues by Porphyromonas gingivalis in mice causally links periodontitis and atherosclerosis. PLoS ONE. 2014;9(5):e97811.
Velsko I. M., Chukkapalli S. S., Rivera‐Kweh M. F., Zheng D, Aukhil I., Lucas A. R, Kesavalu L, Periodontal pathogens invade gingiva and aortic adventitia and elicit inflammasome activation in v6 integrin‐deficient mice 2015, Infection and Immunity, 83, 4582–4593.
Widén C, Holmer H, Coleman M, et al.. Systemic inflammatory impact of periodontitis on acute coronary syndrome. J Clin Periodontol. 2016;43(9):713-719.
Wilkins, E., Wilson, L., Wickramasinghe, K., Bhatnagar, P., Leal, J., Luengo‐Fernandez, R.Townsend, N. European Cardiovascular Disease Statistics 2017. Brussels: European Heart Network.
Yan Y, Mao M, Li YQ, Chen YJ, Yu HD, Xie WZ, Huang Q, Leng WD, Xiong J. Periodontitis Is Associated With Heart Failure: A Population-Based Study (NHANES III). Front Physiol. 2022 Apr 20;13:854606.
Zheng D, Liwinski T, Elinav E. Interaction between microbiota and immunity in health and disease. Cell Res. 2020;30:492-506.
