Atteinte pulpaire des dents permanentes immatures (DPI) : quels biomatériaux pulpaires ?
Dossier spécial 25 ans - AONews#30 - Novembre 2019

L’atteinte pulpaire d’une dent permanente immature pose un véritable challenge thérapeutique : réaliser un soin pulpaire permettant la poursuite du développement radiculaire lorsque la pulpe est encore vitale (apexogénèse) ou induisant une fermeture apicale lorsque la pulpe est nécrosée (apexification).
Pour les dents immatures à pulpe vitale, devant l’absence de fermeture apicale et la présence de parois radiculaires divergentes, il est primordial de privilégier les traitements conservateurs de la vitalité pulpaire. C’est en effet, la conservation de la vitalité du tissu pulpaire qui permet l’édification physiologique de la racine. Les traitements entrepris peuvent être le coiffage pulpaire direct et la pulpotomie partielle (pulpotomie de Cvek) ou totale (cervicale) (Aguilar et al. 2011). En cas de nécrose pulpaire, on observe l’arrêt de l’édification radiculaire et de l’apposition dentinaire sur les parois radiculaires. On note alors l’absence de structures anatomiques apicales, associée à un déficit de résistance radiculaire et coronaire (Beslot et al. 2006). Les étapes du traitement endodontique de la dent permanente immature seront donc les mêmes que pour la dent permanente mature à l’exception prêt qu’une médication créant un environnement favorable à la formation de tissus minéralisés dans la région apicale peut être mise en place afin d’induire une barrière apicale. Cette dernière peut être également obtenue mécaniquement par l’apport d’un biomatériau, avant la phase d’obturation canalaire définitive.
De quels biomatériaux disposons-nous aujourd’hui pour ces thérapeutiques ?
Un biomatériau a été défini à la conférence européenne de Chester en 1991 comme tout matériau non vivant utilisé dans un dispositif médical et visant à remplacer, ou traiter un tissu, un organe ou une fonction, et restant en place plus de 3 semaines (afin de le distinguer des médicaments).
L’hydroxyde de calcium
L’hydroxyde de calcium a été pendant des décennies le gold standard pour conserver la vitalité pulpaire en cas d’exposition pulpaire
carieuse ou traumatique, pour induire la fermeture apicale d’une dent immature nécrosée, ou encore pour arrêter une résorption inflammatoire.
Ce produit peut être employé pur : la poudre est mélangée à de l’eau distillée stérile ou une solution anesthésique sans vasoconstricteur.
De nombreuses préparations commerciales sont mises sur le marché : préparations durcissantes ou endocanalaires fluides.
Ce biomatériau est utilisé depuis de nombreuses années pour ses diverses propriétés :
- une action antiseptique et anti-inflammatoire (Tronstad et al. 1981) due à son pH fortement alcalin. Voisin de 12,4, il reste stable en solution aqueuse, mélangé à du sérum physiologique, il descend à 9,4 ;
- une action hémostatique, le calcium étant un des facteurs de la coagulation sanguine (Heithersay 1975) ;
- un effet anabolisant sur les tissus péri-apicaux contribuant à lutter contre les sérosités et les exsudats, dans le cadre du traitement des dents nécrosées (Estrela et al. 1998) ;
- une radio-opacité voisine de celle de la dentine.
Hydroxyde de calcium et apexogénèse
Matériau de référence depuis de nombreuses années, l’hydroxyde de calcium est utilisé dans le but d’obtenir une cicatrisation pulpaire et une réparation dentinaire. Il entraine une nécrose superficielle de la pulpe exposée. Le tissu coagulé nécrosé va progressivement se calcifier et une barrière isolera la pulpe camérale. Le pH élevé prolonge l’effet antibactérien pendant la phase de différenciation cellulaire. Cependant ce matériau peut se dissoudre et laisser un espace vide entre la pulpe et la restauration, favorable à l’infiltration bactérienne. L’intégrité du pont dentinaire induit par l’hydroxyde de calcium n‘est donc pas systématique et devra être contrôlée. Différentes formulations peuvent être utilisées : préparations extemporanées ou commerciales. Lors de sa mise en place, il doit être délicatement posé sur la pulpe sans être foulé, évitant ainsi sa diffusion au sein du tissu pulpaire qui favoriserait le développement de calcifications secondaires internes.
Il n’est pas recommandé d’utiliser le Dycal®. Ce matériau contient de l’oxyde de zinc agressif pour le tissu pulpaire, et les résultats
sont moins favorables.
Hydroxyde de calcium et apexification
Dès 1959, Granath décrit l’utilisation de l’hydroxyde de calcium pour obtenir la fermeture apicale (Rafter 2005). Les thérapeutiques d’apexification avec ce biomatériau ont été codifiées par Franck en 1966 et Heithersay en 1975. Ce matériau a été recommandé pour ses propriétés antibactériennes (Barthel et al. 1997), sa capacité à dissoudre les débris pulpaires nécrotiques (Hasselgren et al. 1988) et sa participation à l’induction de tissus minéralisés (Javelet et al. 1985),
Pourtant son utilisation est actuellement discutée car elle présente de nombreux inconvénients : le traitement est long de par la nécessité de renouveler le matériau, ce qui requiert la coopération et l’assiduité du patient. De plus aucun consensus n’existe sur la périodicité de renouvellement du matériau. Son changement répété et la sollicitation réitérée de l’apex peut empêcher la formation de la barrière apicale (Felippe et al. 2005). La durée du traitement a pour conséquence des modifications ultrastructurelles de la dentine des parois radiculaires,
augmentant le risque de fractures (Andreasen et al. 2002). Enfin, la fermeture apicale n’est pas toujours obtenue, le taux de succès variant dans la littérature de 74% à 100% (Kirinons 2001, Domingues Reyes 2005).
Le MTA® (Mineral Trioxide Aggregate)
En 1993, après sa première description par Lee et al. dans la littérature dentaire, le MTA® est introduit comme matériau d’obturation a retro pour la chirurgie endodontique, afin d’obtenir un scellement apical. Ce matériau est composé d’une poudre constituée de fines particules hydrophiles contenant principalement des oxydes minéraux (silicates tricalciques, aluminates tricalciques, oxydes tricalciques et oxydes de silicate). De l’hydratation de cette poudre, dans une proportion 3 doses de poudre pour 1 dose d’eau stérile, résulte la formation d’un gel colloïdal qui se solidifie en moins de 3 heures.
Deux formulations existent : une poudre grise, et une poudre blanche mise sur le marché secondairement dans un souci esthétique, la
première formulation entrainant des dyschromies de la couronne.
Le MTA® présente de nombreuses propriétés :
- son pH basique est de 10,2 après malaxage et atteint 12,5 après 3 heures et cette alcalinité reste constante après ce délai (Torabinejad 1995) ;
- le MTA® possède une action bactéricide, moindre que celle de CaOH2, qui est limitée aux bactéries anaérobies facultatives, n’ayant aucun
effet sur les anaérobies strictes (Torabinejad 1995, Estrela 2000);
- il présente une faible cytotoxicité (Keiser et al. 2000) et une bonne biocompatibilité (Torabinejad et al. 1995, 1997, Mitchell et al.1999) ;
- il est insoluble dans l’eau après la prise et présente une bonne résistance à la compression ;
- sa nature hydrophile et sa lente réaction de prise lui confèrent de bonnes propriétés d’étanchéité et de scellement ;
- sa radio-opacité (due à la présence d’oxyde de bismuth) est supérieure à celle de la dentine ;
- le MTA® a un pouvoir d’induction de tissus minéralisés, il favorise et stimule la régénération des tissus, tant pulpaires (Tziafas et al. 2002) que parodontaux (Simon et al. 2007).
MTA® et apexogenèse
Depuis le milieu des années 1990, ce matériau est reconnu comme le matériau de référence pour les traitements conservateurs de la vitalité sur les dents permanentes immatures, surclassant l’hydroxyde de calcium (Faraco et Holland 2001, Caceido et al. 2006, Deery, 2007, Nair et al. 2008, Matsuura et al 2019). Comme l’hydroxyde de calcium, le MTA® induit la formation d’un « pont dentinaire » quand utilisé en coiffage direct, pulpotomie partielle ou cervicale (Pittford et al. 1996, Faraco et al. 2001, Andelin et al. 2003, Dominguez et al. 2003, Aeinehchi et al. 2003). Le MTA®
promeut une croissance cellulaire in vitro plus rapide que CaOH2 (Mitchell et al. 1999). Les études chez l’animal et l’humain ont montré que ce matériau stimule une barrière plus épaisse de nature identique à la dentine primaire (Tran et al. 2019), une moindre inflammation et une plus grande habilité à maintenir la vitalité pulpaire (Pitt Ford et al. 1996, Faraco et al. 2001). La barrière dentinaire est induite à son contact (Bogen et al. 2008).
Le MTA® est supérieur à l’hydroxyde de calcium pour le coiffage pulpaire direct : 98% de conservation pulpaire à 9 ans (Bogen 2008). En ce qui concerne la pulpotomie partielle ou totale, la différence n’est pas statistiquement significative : 91% pour CaOH2 et 93% pour le MTA® (Qudeimat et al 2007, Aguilar et Linsuwanont, 2011).
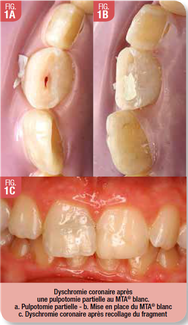
Le MTA® entraine une dyschromie coronaire inesthétique, qui n’est pas grave en soi quand il s’agit du traitement d’une molaire mais qui pose un problème lorsque le traitement concerne une dent antérieure. (Fig. 1)
Le MTA® et apexification
La technique consiste à mettre en place un bouchon de MTA® dans les 4 derniers millimètres apicaux, fermant ainsi l’apex et permettant l’obturation canalaire conventionnelle, créant ainsi un scellement rapide et étanche. Sa réaction de prise nécessite un environnement aqueux. Ainsi, la présence de sang ou d’humidité (Torabinejad et al. 1995) n’est pas incompatible.
Le MTA® est apporté au niveau apical à l’aide du MTA gun® (Dentsply) puis tassé avec des fouloirs endodontiques. Sa manipulation est délicate, sa maîtrise demande une certaine expérience et l’utilisation d’aides optiques est recommandée. Une boulette de coton stérile et humide est laissée dans le canal pendant au moins 3 heures (MTA® gris) et 5 à 12 heures pour le MTA® blanc. L’obturation à la gutta-percha peut être effectuée en 2 visites, voire en 1 visite (Witherspoon et al. 2001) diminuant ainsi le nombre de séances et le temps de coopération du patient. Ce matériau devient donc une meilleure alternative à l’hydroxyde de calcium pour la thérapeutique d’apexification. Toutefois, en cas d’infection périapicale, et de suintement canalaire non endigué, le MTA® ne peut remplacer l’hydroxyde de calcium dans la phase initiale d’antisepsie et d’assèchement périapical. Dans ce cas précis, ces deux matériaux deviennent complémentaires.
La Biodentine™
La BiodentineTM est un ciment de la même classe que le MTA®. Ce matériau à base de silicate de calcium présente des propriétés physico-chimiques proches des dérivés du ciment Portland (Saidon et al. 2003) :
- au niveau biologique, il est parfaitement biocompatible (Laurent et al. 2008) et capable d’induire l’apposition de dentine réactionnelle épaisse et dense en stimulant l’activité des odontoblastes (Goldberg et al. 2009), et de dentine réparatrice, par induction d’une différenciation cellulaire (Shayegan et al. 2010) ;
- l’induction de la minéralisation est identique et plus rapide que le MTA® (Shayegan et al. 2010) ;
- il s’agit d’un substitut dentinaire qui peut être mis en place au contact de la pulpe. Ce type de ciment est par définition résistant à la dégradation hydrique ;
- son temps de prise raccourci (9 à 12 min) autorise soit la réalisation immédiate de la restauration coronaire d’usage (Tran et al. 2008), soit sa mise « en fonction» directe au niveau intra-oral sans craindre sa détérioration ;
- contrairement au MTA®, la Biodentine™ n’entraine pas de dyschromie.
Biodentine™ et apexogenèse
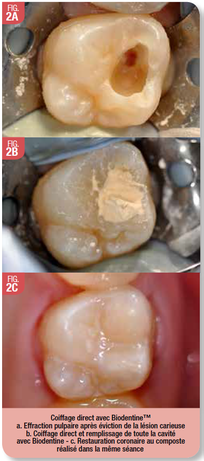
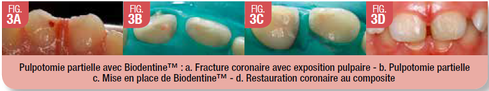
Ce matériau peut être utilisé pour toute thérapeutique de coiffage pulpaire (Fig. 2) ou de pulpotomie (Fig. 3). Biodentine™ peut être maintenue en tant que matériau d’obturation transitoire pendant 6 mois, ce qui permet de s’assurer d’une bonne réponse pulpaire au traitement avant de réaliser la restauration coronaire définitive.
Le mélange de la poudre contenue dans une capsule et du liquide se fait pendant 30s avec un vibreur. Le mélange obtenu est déposé sur l’exposition pulpaire à l’aide d’une spatule ou d’un porte amalgame réservé à cet effet. La cavité carieuse est alors remplie totalement.
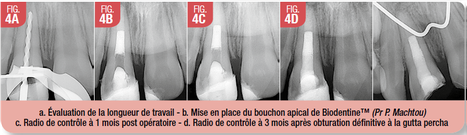
Biodentine™ et apexification (Fig. 4)
Le bouchon de Biodentine™ doit être déposé à l’apex sur une épaisseur de 4 mm de manière identique au MTA®. Toutefois ce matériau demande
une dextérité particulière pour la thérapeutique d’apexification de par son durcissement rapide qui autorise alors une obturation canalaire en une seule séance. Tout comme pour le MTA®, il est nécessaire d’obtenir l’assèchement du canal avant de réaliser l’obturation définitive.
Quels biomatériaux en 2019 ?
La préservation maximale du tissu pulpaire est une évidence clinique aujourd’hui et doit être mise en œuvre selon des protocoles rigoureux (European Society of Endodontology 2019).
Le WhiteProRoot®MTA est devenu le gold standard dans les procédures d’apexogénèse (Matsuura et al. 2019, Paula et al. 2018, Paula et al. 2019). De nombreuses études récentes montrent des résultats significativement comparables entre la Biodentine™ et le MTA® (Awawdeh et al. 2018, European Society of Endodontology 2019, Matsuura et al. 2019, Paula et al. 2018, Paula et al. 2019,
Tran et al. 2019), voir une meilleure réponse biologique de la pulpe traitée par la Biodentine™ (Paula et al. 2019, Yaemkleebbua et al. 2019). Des études ont également été publiées proposant de nouveaux matériaux ayant des résultats prometteurs pour le coiffage pulpaire : Emdogain® (protèines de la matrice amélaire) (Matsuura et al. 2019, Paula et al. 2018, Youssef et al. 2019) et TotalFill®BC RRM™ (biocéramique) (Kamal et al. 2018), ou de nouvelles techniques comme la pré-irradiation de la pulpe exposée au laser à CO2 avant l’application du matériau de coiffage pulpaire (Suzuki et al. 2019).
Ces matériaux nécessitent des études plus approfondies.
La régénération pulpaire : une alternative possible à la thérapeutique d’apexification ?
Néanmoins à l’heure actuelle, nous pourrions paraphraser l’article de Huang en 2009 : « Apexification : le début de la fin ». En effet, une nouvelle thérapeutique pour les dents nécrosées se profile : la régénération.
La mise en évidence de cellules souches pluripotentes dans la pulpe des dents adultes (Gronthos et al. 2000) puis temporaires (Miura et al. 2003), ainsi que dans la papille dentaire apicale des dents immatures (Huang et al. 2008) est à l’origine d’une approche prometteuse mais encore à valider concernant le traitement des dents immatures infectées. Cette méthode fait appel au potentiel réparateur des cellules de la papille dentaire, par le biais d’une revascularisation du canal après une surinstrumentation apicale délibérée (Machtou 2010). Lors de la première séance, le canal est désinfecté. Lors de la seconde visite, un saignement est créé qui envahit le canal. Le caillot sanguin est alors recouvert avec du MTA® ou la Biodentine™ et la cavité d’accès obturée de manière étanche. Ce traitement permet non seulement l’apexogenèse, mais également l’épaississement des parois radiculaires.
Le futur après 2019 : aura t’on encore besoin d’un biomatériau ?
Les pulpotomies cervicales ne permettent pas de conserver un tissu pulpaire au niveau caméral.
Des études très récentes proposent un nouveau protocole de régénération de ce complexe dentino-pulpaire. Après l’exérèse de la pulpe centrale, des facteurs de croissance sont déposés au contact de la pulpe radiculaire vivante. Cela activerait la prolifération et la différenciation des cellules souches présentes dans le tissu pulpaire résiduel. (Morotomi et al. 2019).
Conclusion
Les thérapeutiques d’apexogénèse sur dent permanente immature ont un taux de succès élevé. Actuellement, les indications de la conservation de la vitalité pulpaire sont élargies aux dents permanentes matures.
Le MTA® et la Biodentine™ sont aujourd’hui considérés comme des matériaux de choix. De nouveaux matériaux et de nouveaux protocoles se profilent mais des études cliniques plus avancées sont nécessaires.
BIBLIOGRAPHIE :
- Aeinehchi M, Eslami B, Ghanbariha M, Saffar AS. Mineral trioxide aggregate (MTA) and calcium hydroxide as pulp-capping agents in human teeth: a preliminary report. Int Endod J. 2003 Mar;36(3):225-31.
- Andelin WE, Shabahang S, Wright K, Torabinejad M. Identification of hard tissue after experimental pulp capping using dentin sialoprotein (DSP) as a marker. J Endod 2003;29: 646 –50
- Andreasen JO, Farik B, Munksgaard EC. Long-term calcium hydroxide as a root canal dressing may increase risk of root fracture. Dent Traumatol. 2002 Jun;18(3):134-7.
- Aguilar P, Linsuwanont P. Vital pulp therapy in vital permanent teeth with cariously exposed pulp: a systematic review. J Endod. 2011 May; 37(5):581-7.
- Asgary S, Eghbal MJ. A clinical trial of pulpotomy vs. root canal therapy of mature molars. Journal of dental research. 2010 Oct;89(10):1080-5.
- Awawdeh L, Al-Qudah A, Hamouri H, Chakra RJ. Outcomes of Vital Pulp Therapy Using Mineral Trioxide Aggregate or Biodentine: A Prospective Randomized Clinical Trial. J Endod. 2018 Nov;44(11):1603-1609.
- Barthel CR, Levin LG, Reisner HM, Trope M. TNF-alpha release in monocytes after exposure to calcium hydroxide treated Escherichia coli LPS.Int Endod J. 1997 May;30(3):155-9.
- Beslot A, Lasfargues JJ. Une démarche clinique fondée sur la preuve : Mineral Trioxyde Aggregate MTA® matériau d’apexification ? Inf Dent 2004 ; 86 (35) : 2263-2273
- Bogen G, Kim JS, Bakland LK. Direct pulp capping with mineral trioxide aggregate: an observational study. J Am Dent Assoc. 2008 Mar;139(3):305-15; quiz 305-15.
- Caicedo R, Abbott PV, Alongi DJ, Alarcon MY. Clinical, radiographic and histological analysis of the effects of mineral trioxide aggregate used in direct pulp capping and pulpotomies of primary teeth. Aust Dent J 2006; 51:297–305.
- Collège National des Enseignants en Odontologie Conservatrice et Endodontie. Dictionnaire Francophone des termes d’Odontologie Conservatrice- Endodontie et odontologie restauratrice. Editions Espace ID, 2010.
- Deery C. Mineral trioxide aggregate a reliable alternative material for pulpotomy in primary molar teeth. Is mineral trioxide aggregate more effective than formocresol for pulpotomy in primary molars? Evid Based Dent. 2007; 8(4):107.
- Domingues Reyes A. Munoz Munoz L, Aznar Martin T. Study of calcium hydroxide apexification in 26 young permanent incisors. Dent Traumatol 2005; 21 (3) 141-45
- Dominguez MS, Witherspoon DE, Gutmann JL, Opperman LA. Histological and scanning electron microscopy assessment of various vital pulp-therapy materials. J Endod 2003;29:324 –33.
- Elmsmari F, Ruiz XF, Miró Q, Feijoo-Pato N, Durán-Sindreu F, Olivieri JG. Outcome of Partial Pulpotomy in Cariously Exposed Posterior Permanent Teeth: A Systematic Review and Meta-analysis. J Endod. 2019 Sep 9.
- Estrela, Pimenta FC, Ito Y, Bamann LL In vitro determination of direct antimicrobial effect of calcium hydroxide J Endod 1998 24: 15-17
- Estrela C, Bammann LL, Estrela CR, Silva RS, Pécora JD. Antimicrobial and chemical study of MTA, Portland cement, calcium hydroxide paste, Sealapex and Dycal.Braz Dent J. 2000;11(1):3-9
- European Society of Endodontology (ESE) developed by: Duncan HF, Galler KM, Tomson PL, Simon S, El-Karim I, Kundzina R, Krastl G, Dammaschke T,Fransson H, Markvart M, Zehnder M, Bjørndal L. European Society of Endodontology position statement: Management of deep caries and the exposed pulp. Int Endod J. 2019 Jul;52(7):923-934.
- Faraco IM Jr, Holland R. Response of the pulp of dogs to capping with mineral trioxide aggregate or a calcium hydroxide cement. Dent Traumatol. 2001 Aug;17(4):163-6.
- Felippe MCS, Felippe WT, Marques MM, Antoniazzi JH. The effect of the renewal of calcium hydroxide paste on the apexification and perapical healing of teeth with incomplete root formation Int Endod J 2005, 38 (7): 436-442
- Frank AL. Therapy for the divergent pulpless tooth by continued apical formation. J Am Dent Assoc. 1966 Jan;72(1):87-93.
- Glickman GN, Bakland LK, Fouad AF, Hargreaves KM, Schwartz SA. Diagnostic terminology: report of an online survey. J Endod. 2009 Dec;35(12):1625-33.
- Goldberg M, Pradelle-Plasse N, Tran XV, Colon P, Laurent P, Aubut V, About I, Boukpessi T, Septier D. Biocompatibility or cytotoxic effects of dental composites- Chapter VI Emerging trends in (bio)material research. Working group of ORE- FDI- 2009- edited by Goldberg M.
- Gronthos S, Mankani M, Brahim
J, Robey PG, Shi S. Postnatal human dental pulp stem cells (DPSCs) in vitro and in vivo. Proc Natl Acad Sci U S A. 2000 Dec 5;97(25):13625-30.
- Hasselgren G, Olsson B, Cvek M. Effects of calcium hydroxide and sodium hypochlorite on the dissolution of necrotic porcine muscle tissue. J Endod. 1988 Mar;14(3):125-7
- Heithersay GS. Calcium hydroxide in the treatment of pulpless teeth with associated pathology. J Dent Res 1975 8: 74-93
- Huang GT, Sonoyama W, Liu Y, Liu H, Wang S, Shi S. The hidden treasure in apical papilla: the potential role in pulp/dentin regeneration and bioroot engineering. Endod. 2008 Jun;34(6):645-51. Review.
- Kamal EM, Nabih SM, Obeid RF, Abdelhameed MA. The reparative capacity of different bioactive dental materials for direct pulp capping. Dent Med Probl. 2018 Apr-Jun;55(2):147-152.
- Keiser K, Johnson CC, Tipton DA Cytotoxicity of MTA using human periodontal ligament fibroblasts. J Endod 2000, 26(9): 557 (Abstract 21)
- Kirinons MJ, Srinivasan V, Welbury RR, Finucane D. A study in two centers of variations in the time of apical barrier position in non vital immature permanent incisors Int J Paediatr Dent 2001; 11 (6): 447-451
- Laurent P, Camps J, De Méo M, Déjou J, About I. Induction of specific cell responses to a Ca3SiO5-based posterior restorative material. Dent Mater. 2008 Nov ; 24(11) : 1486-94.
- Lee SF, Monsef M, Torabinejad M. Sealing ability of a mineral trioxide aggragate for repair of lateral root perforations. J Endod 1993, 19 (11): 541-44
- Matsuura T, K S Kawata-Matsuura V, Yamada S. Long-term clinical and radiographic evaluation of the effectiveness of direct pulp-capping materials. J Oral Sci. 2019 Mar 28;61(1):1-12.
- Machtou P Deux décennies d’endodontie Réalités Cliniques 2010, 21 (1): 41-51
- McDougal RA, Delano EO, Caplan D, Sigurdsson A, Trope M. Success of an alternative for interim management of irreversible pulpitis. J Am Dent Assoc. 2004 Dec;135(12):1707-12.
- Mitchell PJ, Pitt Ford TR, Torabinejad M, McDonald F. Osteoblast biocompatibility of mineral trioxide aggregate. Biomaterials. 1999 Jan; 20(2):167-73.
- Miura M, Gronthos S, Zhao M, Lu B, Fisher LW, Robey PG, Shi S. SHED: stem cells from human exfoliated deciduous teeth. Proc Natl Acad Sci U S A. 2003 May 13;100(10):5807-12. Epub 2003 Apr 25
- Morotomi T, Washio A, Kitamura C. Current and future options for dental pulp therapy. Jpn Dent Sci Rev. 2019 Nov;55(1):5-11.
- Nair PN, Duncan HF, Pitt Ford TR, Luder HU. Histological, ultrastructural and quantitative investigations on the response of healthy human pulps to experimental capping with mineral trioxide aggregate: a randomized controlled trial. Int Endod J. 2008 Feb;41(2):128-50. Epub 2007 Oct 23.
- Nair PN, Duncan HF, Pitt Ford TR, Luder HU. Histological, ultrastructural and quantitative investigations on the response of healthy human pulps to experimental capping with mineral trioxide aggregate: a randomized controlled trial. Int Endod J. 2008 Feb;41(2):128-50.
- Parirokh M, Torabinejad M. Mineral trioxide aggregate: a comprehensive literature review--Part III: Clinical applications, drawbacks, and mechanism of action. J Endod. 2010 Mar;36(3):400-13.
- Paula A, Laranjo M, Marto CM, brantes AM, Casalta-Lopes J, Gonçalves AC, Sarmento-Ribeiro AB, Ferreira MM, Botelho MF, Carrilho E. Biodentine™ Boosts, WhiteProRoot®MTA Increases and Life® Suppresses Odontoblast Activity. Materials (Basel). 2019 Apr 11;12(7).
- Paula AB, Laranjo M, Marto CM, Paulo S, Abrantes AM, Casalta-Lopes J, Marques-Ferreira M, Botelho MF, Carrilho E. Direct Pulp Capping: What is the Most Effective Therapy?-Systematic Review and Meta-Analysis. J Evid Based Dent Pract. 2018 Dec;18(4):298-314.
- Pitt Ford TR, Torabinejad M, Abedi HR, Bakland LK, Kariyawasam SP. Using mineral trioxide aggregate as a pulp-capping material. J Am Dent Assoc 1996;127:1491– 4.
- Qudeimat MA, Barrieshi-Nusair KM, Owais AI. Calcium hydroxide vs mineral trioxide aggregates for partial pulpotomy of permanent molars with deep caries. Eur Arch Paediatr Dent 2007;8:99 –104.
- Rafter M. Apexification: a review . Dent Traumatol 2005: 21 (1): 1-8
- Reyes-Carmona JF, Felippe MS, Felippe WT. Biomineralization ability and interaction of mineral trioxide aggregate and white portland cement with dentin in a phosphate-containing fluid. J Endod. 2009 May;35(5):731-6.
- Saidon J., He J., Zhu Q., Safavi K., Spangberg L. Cell and tissue réactions to mineral trioxide aggregate and Portland cement. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2003 ; 95 : 483- 489.
- Shayegan A, Petein M, Vanden Abbeele A. CaSiO, CaCO, ZrO (BiodentineTM) : a new biomaterial used as pulp-capping agent in primary pig teeth. Poster at IADT 16th World Congress Dental Traumatology, 2010 June Verona Italy
- Simon S, Rillard F, Berdal A, Machtou P. The use of mineral trioxide aggregate in one-visit apexification treatment: a prospective study. Int Endod J 2007 Mar;40(3):186-97
- Stanley HR, Lundy T. Dycal therapy for pulp exposures. Oral Surg Oral Med Oral Pathol. 1972 Nov;34(5):818-27.
- Suzuki M, Kato C, Kawashima S, Shinkai K. Clinical and Histological Study on Direct Pulp Capping With CO2 Laser Irradiation in Human Teeth. Oper Dent. 2019 Jul/Aug;44(4):336-347.
- Tay FR, Pashley DH, Rueggeberg FA, Loushine RJ, Weller RN. Calcium phosphate phase transformation produced by the interaction of the portland cement component of white mineral trioxide aggregate with a phosphate-containing fluid. J Endod. 2007 Nov;33(11):1347-51. Epub 2007 Aug 23.
- Torabinejad M, Hong CU, McDonald F, Pitt Ford TR. Physical and chemical properties of a new root-end filling material. J Endod. 1995 Jul; 21(7):349-53.
- Torabinejad M, Hong CU, Lee SJ, Monsef M, Pitt Ford TR. Investigations of MTA for root-end filling in dogs. J Endod 1995, 21(12): 603-607
- Torabinejad M, Pitt Ford TR, Mc Kendry DJ et al Histologic assessment of mineral trioxide aggregate as a root-end filling in monkeys J Endod 1997, 23(4): 225-228
- Tran V, Pradelle-Plasse N, Colon P. Microleakage of a new restorative calcium based cément (BiodentineTM). Oral présentation PEF IADR 2008 Sep, London.
- Tran XV1, Salehi H, Truong MT, Sandra M, Sadoine J, Jacquot B, Cuisinier F, Chaussain C5, Boukpessi T. Reparative Mineralized Tissue Characterization after Direct Pulp Capping with Calcium-Silicate-Based Cements. Materials (Basel). 2019 Jun 29;12(13).
- Tronstad L, Andreasen JO, Hasselgren G, Kristerson L. pH changes in dental tissues after root canal filling with calcium hydroxide . J Endod 1981 7:17-21
- Witherspoon DE, Ham K. One-visit apexification: technique for inducing root-end barrier formation in apical closures. Pract Proced Aesthet Dent 2001; 13 (6): 455-460
- Witherspoon DE. Vital pulp therapy with new materials: new directions and treatment perspectives-permanent teeth. Pediatr Dent. 2008 May-Jun; 30(3):220-4.
- Yaemkleebbua K, Osathanon T, Nowwarote N, Limjeerajarus CN, Sukarawan W. Analysis of hard tissue regeneration and Wnt signalling in dental pulp tissues after direct pulp capping with different materials. Int Endod J. 2019 May 25.
- Youssef AR, Emara R, Taher MM, Al-Allaf FA, Almalki M, Almasri MA, Siddiqui SS. Effects of mineral trioxide aggregate, calcium hydroxide, biodentine and Emdogain on osteogenesis, Odontogenesis, angiogenesis and cell viability of dental pulp stem cells. BMC Oral Health. 2019 Jul 2;19(1):133.